②物質量の表し方
📌 はじめに
化学の世界では、すべての物質は「原子」と「分子」からできているという基本を理解することが出発点です。
この考え方を押さえておくと、以降の化学計算や反応式の理解がぐっと楽になりますよ。

🔹 1. 原子とは?(物質の最小単位)
✔ 原子(atom) は、元素を構成する もっとも小さな粒子 です。
- 元素とは、これ以上分けられない基本的な物質。
- 例:水素、炭素、酸素など
原子は内部構造を持っていて、中心の 原子核(+) のまわりを 電子(-) が回っています。
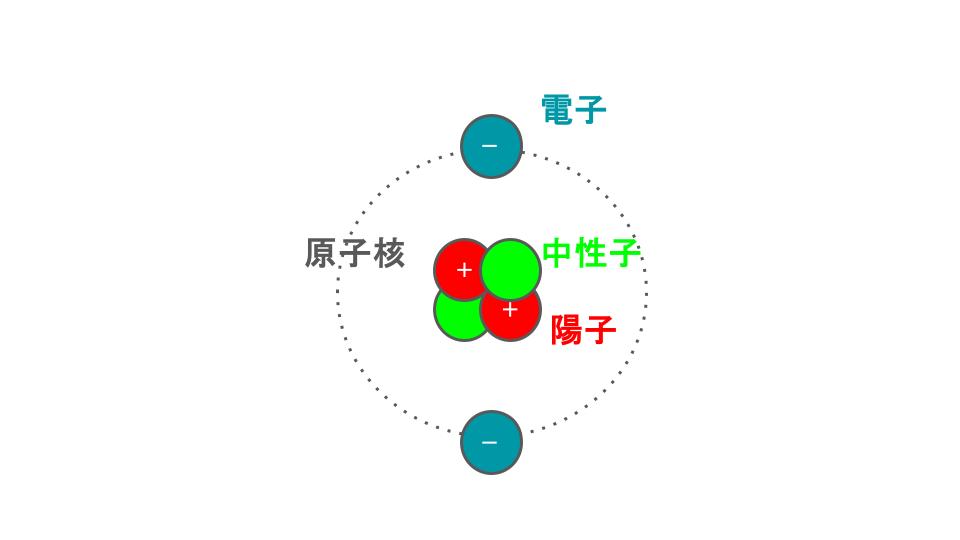
🔹 2. 分子とは?(原子どうしの結びつき)
✔ 分子(molecule) は、2個以上の原子が結びついた粒子 です。
- 例:水(H₂O)は、水素原子2個+酸素原子1個 からできています。
- 酸素分子(O₂)は 酸素原子2個 が結びついたものです。
👉 分子は原子が集まってできた粒子 というイメージで OK。
🔹 3. 原子量・分子量とは?
物質の「重さ」を比較するために、原子や分子の質量の基準 が必要になります。
✔ 原子量
- 炭素原子の質量を基準にした相対的な質量です。
- 水素は炭素の12分の1なので、原子量 = 1 とされています。
✔ 分子量
- 分子に含まれる原子量の合計です。
例)CO₂(炭素1+酸素2)
12(C)+ 16×2(O₂) = 44
→ CO₂ の分子量 = 44
🔹 4. 物質量 mol とは?(化学計算の基本)
原子や分子の数は途方もなく多いため、「mol(モル)」 という単位で扱います。
✔ 1 mol(モル) = 6.02 × 10²³ 個
・・・この数の原子や分子を 1 mol と呼びます。
例えば:
- H₂O の 1 mol = 6.02 × 10²³ 個の水分子 です。
🔹 5. モル質量とは?
✔ モル質量 とは:
1 mol の物質の重さ(g) です。
これは分子量・原子量と同じ数値になります。
例:
- H₂O の分子量 18 → 1 mol の水 = 18 g
- CO₂ の分子量 44 → 1 mol の二酸化炭素 = 44 g
覚えておきたい物質とモル質量:
| 物質 | モル質量 |
| 水素H₂ | 2 |
| 酸素O₂ | 32 |
| 窒素N₂ | 28 |
| 二酸化炭素CO₂ | 44 |
| プロパンC₃H₈ | 44 |
| ブタンC₄H₁₀ | 58 |
6. まとめ(受験者用)
| 用語 | 意味 | 例 |
|---|---|---|
| 原子 | 物質を構成する最小の粒子 | H(1個) |
| 分子 | 原子が集合した粒子 | H₂O、O₂ |
| 原子量 | 原子の相対質量 | H = 1、O = 16 |
| 分子量 | 分子の原子量の合計 | CO₂ = 44 |
| mol | 6.02×10²³ 個 | 1 mol = この数の分子 |
- 原子量・・・炭素(C)を質量12として、比べてそれぞれの質量を表す。
- 分子量・・・分子に含まれる原子を足した質量。
- mol・・・1molは原子量または分子量にgをつけたのと同じ。
例:H₂Oの分子量は18、水1molは18g。


コメント