③化学と気体の法則
📌 はじめに
・ボイルの法則
・シャルルの法則
・ボイル・シャルルの法則
は出題頻度高めです。ここでも図でイメージ理解するのが効果的です。
コツはボイルとシャルルが混同しないようにすること。
こういうのは、「どっちがどっちだっけー?」にならないように。まずは片方だけ覚えるのがいいです。

🎯 1.覚えておきたい基本の法則
🔹 質量保存の法則
化学反応(化学変化)では
👉 物質の種類や組み合わせが変わっても、
→ 質量の合計は変わらない
※ これは原子が増える・減ることなく並べ替わるだけだからです。
例:
C(12g) + O₂(32g) → CO₂(44g)
反応前後で質量は同じです。
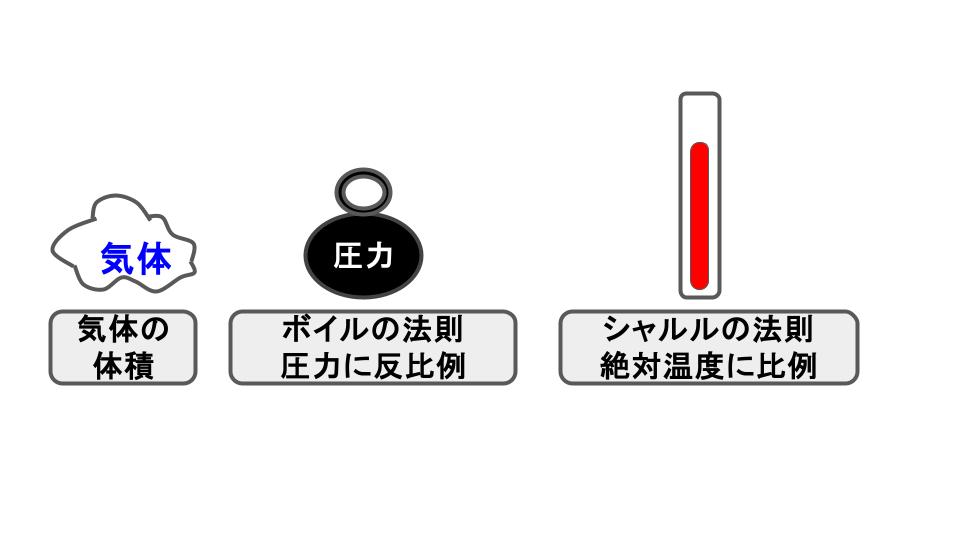
📈 2.気体の法則(基本)
気体の状態は 温度・圧力・体積 で変化します。
これらの関係を示す代表的な法則は次の通りです👇
🟦 ボイルの法則
一定の温度のもとで、
👉 圧力と体積は逆比例する
圧力P×気体の体積V=k(kは定数)
例:
温度が20℃、圧力が2、体積が4だったら、2×4=8。
温度が20℃、圧力が4なら、体積は2になり、2×4=8。
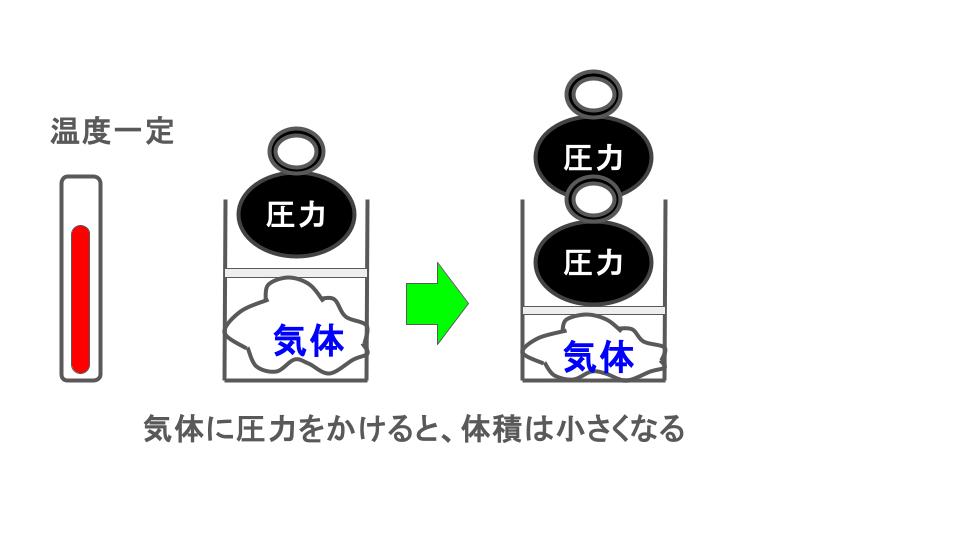
- 圧力 ↑ → 体積 ↓
- 圧力 ↓ → 体積 ↑
(同じ量の気体が入った風船を押すと小さくなるイメージ)
🟥 シャルルの法則
一定の圧力のもとで、
👉 体積は絶対温度(K)に比例する
温度を絶対温度(セ氏温度+273度)で表すと、気体の体積(V)は絶対温度(T)に比例する。
圧力が一定のとき、気体の体積(V)は温度が1℃上昇ごとに、0℃のときの体積の1/273ずつ上昇する。
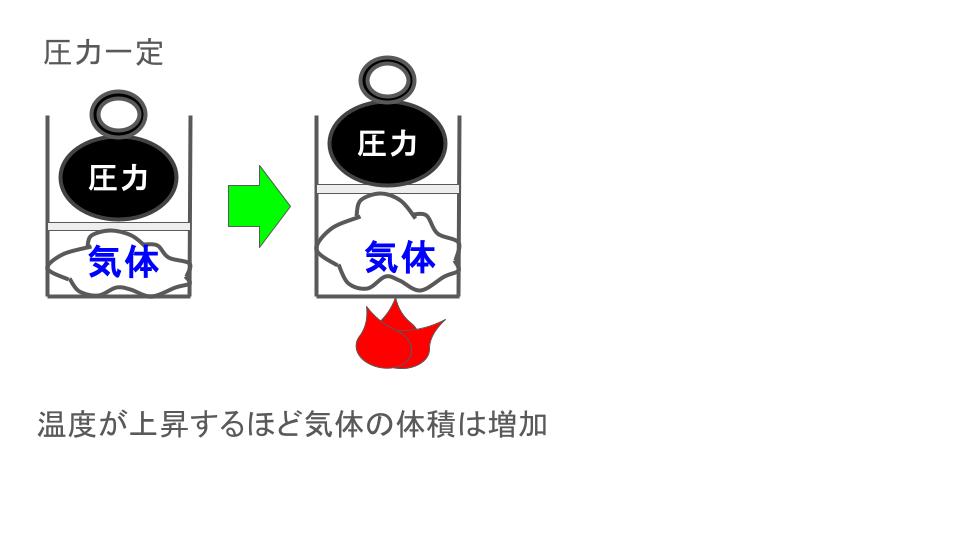
- 温度 ↑ → 体積 ↑
- 温度 ↓ → 体積 ↓
(温かい空気は膨らむ・冷たいと縮む)
※ 温度は**ケルビン(K)**で扱う
(℃ + 273 = K)。
⭕️ ボイル・シャルルの法則(合わせ技)
両方を合わせると:
ボイルの法則とシャルルの法則を併せて考えると、一定の気体の体積(V)は、圧力(P)に反比例し、絶対温度(T)に比例する。これをボイル・シャルルの法則という。
つまり、
👉 温度が上がると 体積は大きくなり、
👉 圧力が上がると 体積は小さくなる
ということです。
あらゆる温度、圧力で、ボイルの法則やシャルルの法則に従うと仮定した気体を理想気体という。
📊 3.アボガドロの法則(気体の分子数)
同じ条件(T・P)のもとで、同じ体積の気体は
👉 どんな気体でも 同じ数の分子を含む
この法則は、体積と物質量(mol)の関係を理解するときに便利です。
たとえば、標準状態では 1 mol 気体は 22.4 L(覚え方だけでも押さえておきましょう)
📌 “判断フロー”で覚える
1️⃣ まず確認
👉 何が一定か?
(温度?圧力?体積?)
2️⃣ 当てはめるだけ
✔ 温度一定 → ボイルの法則
👉 圧力↑=体積↓(反比例)
✔ 圧力一定 → シャルルの法則
👉 温度↑=体積↑
※温度はK(℃+273)
❌ “運営者が間違えた思考パターン”3選
私(運営者)の失敗例を紹介します。
🚫 NG①: とりあえず式を書き始めた
→ 「何が一定か」を見ずに計算して迷子になる。
🚫 NG②: 温度を℃のまま使った
→ ケルビンに直さず計算して全滅。
※ ℃+273=K
🚫 NG③: 反比例を逆に考えた
→ 圧力↑で体積も↑と考えてしまう。
正しくは 圧力↑ → 体積↓
💡 4. まとめ
| 法則 | 内容 |
|---|---|
| 質量保存 | 化学変化でも質量は変わらない |
| ボイルの法則 | 一定温度で圧力↑ → 体積↓ |
| シャルルの法則 | 一定圧力で温度↑ → 体積↑ |
| ボイル・シャルル | 圧力・温度をまとめた気体の関係 |
| アボガドロ | 同条件で同体積=同分子数 |
💬 初学者と運営者のミニ対話
初学者
気体って固体や液体と何が違うの?ただ「空気」ってだけじゃないの?😅
運営者
気体は、分子が自由に速く動き回って広がる(広がりやすい)性質を持ってるよ。
固体・液体みたいに形や体積を持たず、容器の大きさに合わせて広がるのが特徴なんだ。
初学者
自由に動くってどういうこと?🤔
運営者
気体の分子は 互いに離れた状態でランダムに動いていて、しっかりした形を保ってないんだ。
だから容器のどこまでも広がったり、圧力をかければ押し縮められたりするよ。
初学者
圧力とか温度とも関係あるんだよね?😳
運営者
そう!
気体は 圧力・体積・温度が互いに関係するルール(気体の法則) に従うよ。
たとえば
温度が上がると分子が速く動いて圧力が上がる
体積を小さくすると圧力が上がる
みたいな関係があるんだ。
初学者
例えるならどんな感じ?😄
運営者
風船があるでしょ?
暖かい場所におくと中の空気(気体)が膨らんで風船が大きくなるよね。
これは 温度が上がる → 分子が速く動く → 風船の内圧が上がる → 体積が広がる って関係なんだ。


コメント